2017/05/02
2158
国内医疗3D打印有哪些拿到了CFDA认证?
在国内从事医疗3D打印领域,3D打印技术本身并不是最大的门槛,而是要通过CFDA认证。目前国内通过CFDA认证的3D打印产品还非常稀有,据了解目前共有四款产品通过了CFDA认证,分别是:爱康医疗与北医三院合作的3D打印髋臼杯、3D打印人工椎体、3D打印脊柱椎间融合器;迈普医学3D打印硬脑(脊)膜补片。

△2015年7月22日,我国首个3D打印人体植入物——人工髋关节产品获得国家食品药品监督管理总局注册批准。本次获得注册的人工髋关节产品属于三类骨科置入物,是我国监管等级最高的医疗器械产品,由北京大学第三医院骨科专家张克、刘忠军、蔡宏等与北京爱康宜诚医疗器材股份有限公司合作研制。2009年,北京大学第三医院骨科关节组负责人张克带领骨科关节组团队将3D打印技术引入骨科,历经3年,研制出我国首个3D打印人工髋关节产品,再3年后通过CFDA认证。
△2016年7月,爱康医疗基于3D ACT技术研发的脊柱椎间融合器正式获得了国家食品药品监督管理总局批准,这也是中国首例获得CFDA上市许可的金属3D打印椎间融合器产品。该产品由北京大学第三医院骨科刘忠军教授团队和爱康医疗共同研发,历经七年研发和临床验证,终于完成了这个自主知识产权创新产品的上市注册审批。国械注准20163461289。3D ACT技术是电子束熔融金属3D打印技术(EBM)、精准解剖结构三维重建技术、医工交互平台和三维设计平台等来自临床医学、计算机技术、材料学和机械设计多方面技术的融合体,相比传统的锻造、铸造、喷涂等技术,轻松实现钛合金植入物和表面类骨小梁结构的自由构建,体现了精准医疗和精准构建的先进科技理念,因此被命名为3D ACT(三维精准构建技术)。
△2016年5月6日,全球首发金属3D打印人体植入物——人工椎体诞生并获CFDA注册批准。获得CFDA注册认证3D打印人工椎体研究团队负责人刘忠军教授表示:“如今有了金属3D打印技术,就可以依照患者的解剖结构,制造出一枚与五节椎体形态与长度相仿的人工椎体。人工椎体优势显著,首先,将其放到切除病变后的相邻椎体之间,能起到可靠的连接和支撑功能。同时利用金属3D打印人工椎体在结构上可以任意设计的便利,专门设计出其与后方内固定结构之间的连接,这种前后连成一体的装置使稳定性大大增强,在力学性能上达到了质的飞越。有了这样的固定方式,术后患者很快便可以下床活动,而人工椎体更大的优势是被制成微孔结构后,形状可像海绵一样,类似骨头中有了‘骨小梁’ ,这种‘骨小梁’可帮助相邻正常椎体的骨细胞长入其中,最终二者融为一体,从而实现骨整合。”
之所以说CFDA门槛高,主要源自三大原因:审核严、周期长、费用高。下面南极熊带你了解CFDA认证:
什么是CFDA?
实际上CFDA是国家食品药品监督管理总局的简称,如果一家公司想在中国境内销售、使用的医疗器械产品均应按照规定向CFDA进行申报注册,未经核准注册的医疗器械,不得销售使用。
认证还分为境内医疗器械注册和境外医疗器械注册,境外医疗器械不管是一类、二类、三类都要到北京国家食品药品监督局办理;境内的一、二类医疗器械在当地的省或市食品药品监督局办理,三类的到国家食品药品监督局办理。医疗器械注册证说白了就是医疗器械产品的合法身份证。
一类、二类、三类认证的区别是什么?
从风险的高低看,一类呢,不会对人体直接造成伤害,例如手术钳、压舌板之类的,你在怎么用也不会直接对人体造成伤害;二类呢,风险稍高,可能会间接的对人体造成较大的伤害,例如一些监护床、诊断仪器,不会直接伤害人,但它的诊断结果的准确与否会给患者带来间接的伤害;三类呢,就是风险最高的医疗器械了,会对患者直接早上较大的伤害,尤其是血液类的、植入物被列为高风险医疗器械,这些器械的不当使用会对人体造成较大的伤害(3D打印钛合金植入物、PEEK植入物属于三类)。
从监管(注册)角度讲的话,一类力度最小,由市局进行备案(即将实施的新条例将提高为省局备案);二类次之,需要在省局注册,并且除药监局贵客可豁免临床产品外,其他产品需做临床,并且有体系审核;三类最高,需检测、临床、进行《规范》审核,需要更多的文件资料证明产品的安全有效性。
从生产角度讲,一类要求最低,不管是人员还是设备,能达到你的要求就行,二类次之,三类最高,三类器械必须满足国家标准或者行业标准的要求,对人员场地设备都有要求,并且有完整的体系,从文件、设备、环境、人员等等方面进行控制。
如何通过CFDA认证?
之所以说CFDA认证门槛高,主要是CFDA申请注册审核严格、周期长、收费高。以国产第三类医疗器械为例,申请人按照首次注册审批服务指南的要求,向国家食品药品监督管理总局行政受理服务大厅提出申请,受理人员根据申报事项按照《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(2014年第43号)、《关于印发境内第三类和进口医疗器械注册审批操作规范》、《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(2014年第44号)的要求对申报资料进行形式审查。
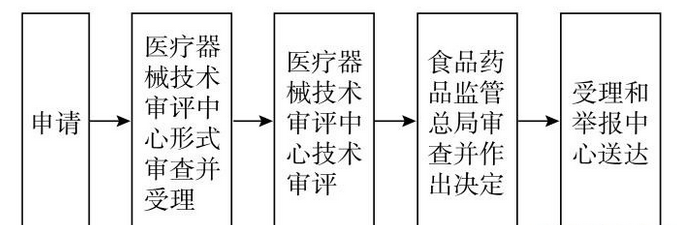
三类注册的收费标准为15.36万元,周期则长达数年不等,需要临床试验的时间比较长。CFDA门槛高,是基于对人们身体健康的考虑,当然也影响到新药新产品应用的进度,很多好产品苦于没有通过认证而无法临床应用。以后,南极熊相信通过CFDA认证的3D打印医疗产品会越来越多,更好的造福人类。


打印无限想象
欢迎莅临广州国际3D打印展览会!
主办单位官方微信









